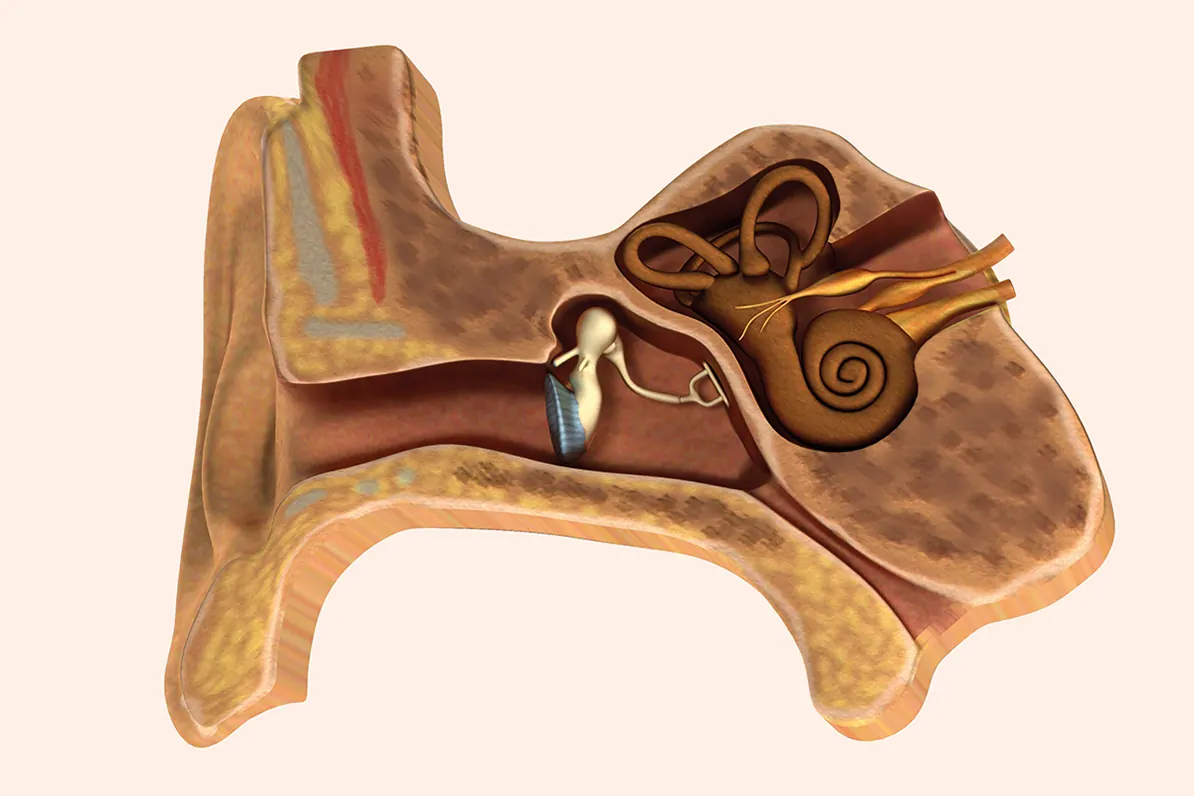
Extraído del libro, Audiología: Teoría y Práctica. Capítulo 2. Anatomía funcional y fisiopatología de los sistemas auditivo, vestibular y fonador.
El órgano de Corti u órgano sensorial de la audición es de origen neuroectodérmico. Sus células son de tipo epitelial especializado y están diferenciadas según su morfología y función en células de soporte y células sensoriales (con características similares a las neuronas ya que sintetizan neurotransmisores que liberan en sus contactos sinápticos). Se disponen principalmente sobre la membrana basilar del conducto coclear y está parcialmente cubierto por la membrana tectoria. La configuración global de este agregado celular varía ligeramente desde las espiras basales hacia las apicales de la Cóclea (Figura 1) (Suárez y cols., 2007).
Existen dos tipos de células sensoriales o receptoras según su localización en el órgano de Corti con relación al eje central del modiolo coclear. Las células ciliadas internas se disponen formando una fila a lo largo del conducto coclear. Están situadas por encima de las células de soporte falángicas internas. En su superficie apical hay tres hileras de cilios en línea recta, con un tamaño decreciente, y unidos entre sí por puentes filamentosos.
Las células ciliadas externas se disponen en tres filas sobre las células falángicas externas. Sus cilios son similares a los de las internas, pero distribuidos en forma de V. Los extremos de los cilios se relacionan con la superficie inferior de la membrana tectoria situada sobre ellos, existiendo un mayor anclaje a ella a medida que las células ciliadas son más externas.
Existen dos tipos de células receptoras según su localización en el órgano de Corti con relación al eje central del modiolo coclear: las células ciliadas internas, que forman una fila a lo largo del conducto coclear; y las células ciliadas externas dispuestas en tres filas sobre las células falángicas externas.
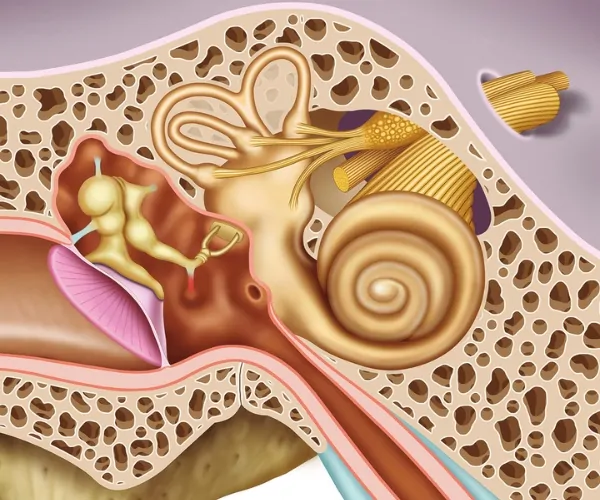
La membrana tectoria, paralela a la membrana basilar, es más estrecha en la base de la cóclea y alcanza doble anchura en las regiones más apicales. Consta de una porción medial delgada, anclada firmemente al limbo espiral, y una porción lateral libre más gruesa, que se sitúa sobre el órgano de Corti. La membrana tectoria es acelular y está compuesta por colágeno, glicoproteínas y glicosaminoglicanos (formando filamentos inmersos en una matriz amorfa mucopolisacárida) que son sintetizados por las células interdentales del limbo espiral interno situado sobre la lámina espiral ósea. Entre el limbo y las células falángicas internas se encuentra el surco espiral interno tapizado por un epitelio de células cúbicas.
La membrana tectoria, paralela a la membrana basilar, es acelular y está compuesta por colágeno, glicoproteínas y glicosaminoglicanos.
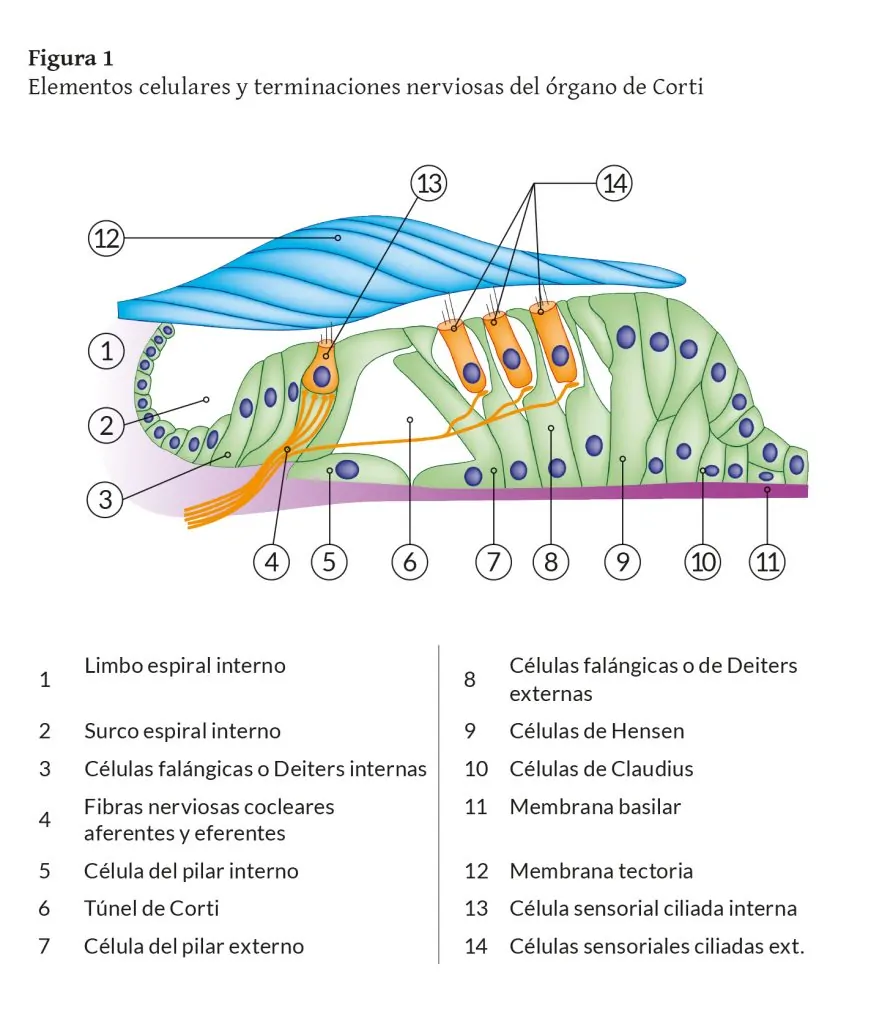
Uno de los tipos de células de soporte son las células de los pilares externo e interno (con forma piramidal alargada y abundantes microtúbulos en su citoesqueleto que le confiere gran consistencia) que configuran el túnel de Corti. Este espacio de sección triangular contiene cortilinfa y se encuentra central en el órgano de Corti. Por su interior pasan fibras nerviosas aferentes (prolongaciones dendríticas de las neuronas del ganglio espiral) y eferentes que se dirigen a la base de las células sensoriales ciliadas externas e internas.
Otras de las células de soporte son las de Deiters o falángicas externas e internas, cuyas prolongaciones digitiformes se ensanchan en el extremo y se unen lateralmente a la región apical de las respectivas células ciliadas externas e internas situadas sobre ellas y bañadas por la cortilinfa que ocupa los espacios de Nüel. Este mosaico de células sensoriales y de soporte unidas por desmosomas constituye la lámina o membrana reticular, la cual delimita la rampa media con perilinfa de los espacios con cortilinfa del órgano de Corti.
El túnel de Corti es un espacio de sección triangular por cuyo interior pasan fibras nerviosas aferentes, prolongaciones dendríticas de las neuronas del ganglio espiral, y eferentes que se dirigen a la base de las células sensoriales ciliadas externas e internas.
Las células de soporte situadas lateralmente a las células de Deiters externas son las células de Hensen, con forma alargada, y las células de Claudius, más cortas y que tapizan el surco espiral externo (Figura 11) (Angulo y cols., 1997; Gil-Carcedo, 2011; Rodríguez y Smith-Agreda, 2004; Suárez y cols., 2007, Williams, 1998).
FUNCIÓN DEL OÍDO INTERNO
Dada la naturaleza mecánica de las ondas de presión sonora que son transmitidas al oído interno, bien por vía aérea (a través de las estructuras del oído externo y medio), o bien por vía ósea (a través de las vibraciones de los huesos del cráneo), el órgano sensorial de Corti actúa como un mecanorreceptor, transformando la energía mecánica del estímulo sonoro en impulsos nerviosos bioeléctricos que serán transmitidos a neuronas de la vía aditiva aferente.
Esta específica función de transducción es realizada por las células receptoras ciliadas externas e internas. Además, a nivel coclear se realiza una función tonotópica o cocleotópica, es decir, una primitiva discriminación tonal (discernir entre frecuencias de sonidos presentados consecutivamente) según la región de la cóclea estimulada.
Dada la naturaleza mecánica de las ondas de presión sonora que son transmitidas al oído interno, el órgano sensorial de Corti actúa como un mecanorreceptor, transformando la energía mecánica del estímulo sonoro en impulsos nerviosos bioeléctricos.
Esto se explica por dos hechos: por un lado, la estimulación de un grupo de células sensoriales situadas sobre una determinada zona de la membrana basilar («teoría del lugar») que se desplaza en sintonía con la frecuencia del sonido, ya que sus características morfológicas le confieren las propiedades físicas adecuadas para ello; por otro, la específica, compleja y coordinada inervación aferente (excitatoria) y eferente (inhibitoria) de las células sensoriales, que hace posible una sintonización o selección frecuencial del sonido por contraste entre dos zonas muy próximas de células ciliadas estimuladas (Haines, 2013; Pickles,1988; Purves, 2015; Suárez y cols., 2007).
Los mecanismos esenciales del proceso de transducción de las células ciliadas del órgano de Corti se fundamentan en cambios en los potenciales endococleares (voltajes de los líquidos intra y extracelulares de la cóclea). Ello es consecuencia de la apertura de canales iónicos provocada por microdeformaciones en la membrana citoplasmática de los cilios de las células sensoriales (unidos entre sí por puentes filamentosos), cuando son desplazados o curvados lateralmente por los movimientos radiales de la membrana tectoria sobre la membrana reticular (Pickles,1988; Suárez y cols., 2007). Estos desplazamientos relativos entre las dos membranas paralelas son originados por las oscilaciones de las ondas sonoras, transmitidas por los líquidos laberínticos.
Los mecanismos esenciales del proceso de transducción de las células ciliadas del órgano de Corti se fundamentan en cambios en los potenciales endococleares.
Según la intensidad y frecuencia del sonido, tanto en la audición por vía aérea (cuando la presión sonora se transmite desde el oído externo y medio al oído interno a través de la base del estribo que se desplaza en la ventana oval), como en la audición por vía ósea (cuando las vibraciones sonoras se transmiten por los huesos del cráneo directamente al oído interno), se generan oscilaciones en la perilinfa que se distribuyen por la rampa vestibular de la cóclea hasta el helicotrema en microsegundos. Luego alcanza el final de la rampa timpánica, donde el tímpano secundario cierra la ventana redonda y compensa dicha presión con desplazamientos alternos a los del estribo. Al mismo tiempo, la presión oscilatoria de la perilinfa actúa sobre las membranas del conducto coclear (de Reissner y basilar con el órgano de Corti) que, a su vez, se transmite a la endolinfa contenida en él y a la membrana tectoria. Esta permanece casi inmóvil por estar unida al limbo espiral interno, por el poco peso específico de sus componentes y por quedar prácticamente anuladas las presiones en sentidos opuestos, transmitidas desde la perilinfa de las rampas vestibular y timpánica a la endolinfa del conducto coclear.
Según la intensidad y frecuencia del sonido, tanto en la audición por vía aérea, como en la audición por vía ósea, se generan oscilaciones en la perilinfa que se distribuyen por la rampa vestibular de la cóclea hasta el helicotrema en microsegundos.
Por tanto, los movimientos desencadenados en la membrana basilar son los más importantes en el proceso de audición. Por su naturaleza elástica y con cierta inercia, se forman ondas viajeras u ondas de desplazamiento que van siempre desde la base hacia el ápex de la cóclea. La velocidad de transmisión de estas ondas por la membrana basilar es más lenta que por el líquido, tardando unos 2 a 5 milisegundos en recorrer los 35 mm de la cóclea (de 2 vueltas y ¾ en el humano). (Pickles,1988; Purves, 2015; Suárez y cols., 2007).
El hecho físico por el que se originan las ondas viajeras se fundamenta en que anatómicamente la membrana basilar va disminuyendo su grosor y aumentando su anchura desde la base hacia el ápex. De forma inversa, la lámina espiral ósea es más ancha en la base y se va estrechando hacia las espiras apicales. Dado que cerca de la ventana oval la membrana basilar tiene mayor cantidad de masa por unidad de longitud, oscila preferentemente con sonidos de altas frecuencias, ya que en esta zona alcanza su máxima amplitud y entra en resonancia su frecuencia de vibración con la del sonido.
La velocidad de transmisión de ondas viajeras a través de la membrana basilar es más lenta que por el líquido, tardando entre 2 y 5 milisegundos en recorrer los 35 mm de la cóclea.
Por el contrario, los sonidos de baja frecuencia desencadenan una onda viajera con una pequeña amplitud en la base que irá aumentando hacia el ápex, a medida que la estructura física de la membrana va cambiando a menor cantidad de masa por longitud. Estas evidencias justifican, según la hipótesis de la «teoría del lugar», la discriminación tonal cocleotópica. Ello consiste en que sonidos de cada frecuencia del campo auditivo harán que un determinado lugar de la membrana basilar alcance su máxima amplitud de oscilación de la onda viajera correspondiente.
La integración del mensaje sonoro se realiza cuando la información sobre intensidad, frecuencia y duración del estímulo sonoro es codificada por tipos neuronales especializados en cada nivel de la vía auditiva.
Así pues, en cada precisa región coclear todas las estructuras del órgano de Corti dispuestas sobre ella se mueven en bloque, ya que las células de los pilares y la lámina reticular aportan rigidez al conjunto celular, y por tanto, los cilios de las células sensoriales reciben una mayor presión mecánica. Además, los desplazamientos relativos de la membrana tectoria respecto a la membrana reticular (en la base de los cilios) son más acentuados en las regiones externas del órgano de Corti que en las internas, existiendo un mayor estímulo mecánico y cizallamiento o incurvación de los cilios de las células ciliadas externas que los de las internas. A mayor intensidad sonora, mayor número de células ciliadas serán excitadas llevando a cabo su función de transducción a impulso nervioso. (Pickles,1988; Purves, 2015; Suárez y cols., 2007).
Anatomía funcional de las vías auditivas centrales
En el sistema auditivo, la vía auditiva central aferente y eferente consta de siete niveles o regiones nerviosas del encéfalo con neuronas conectadas entre sí.
En todos los sistemas sensoriales, el estímulo exterior es captado por el receptor periférico cuyas células sensoriales transforman la señal en estímulo nervioso. Después se procesa la información en distintos niveles o escalones del sistema nervioso central constituyendo una vía nerviosa sensorial aferente o ascendente, con su correspondiente respuesta de control eferente o descendente que llega hasta el órgano receptor periférico.
En el sistema auditivo, la vía auditiva central aferente y eferente consta de siete niveles o regiones nerviosas del encéfalo con neuronas conectadas entre sí (Suárez y cols., 2007).
En el interior del canal de Rosenthal, en torno al modiolo de la cóclea, se aloja el ganglio espiral de Corti. Sus neuronas constituyen el primer nivel de la vía auditiva aferente, ya que las dendritas sinaptan con las células sensoriales y los axones, integrantes del nervio coclear, contactan con las neuronas de los núcleos cocleares del tronco del encéfalo (Angulo, 1987 y 1997).
De aquí parten proyecciones paralelas ipsilaterales y contralaterales, que tras hacer sinapsis en núcleos del complejo olivar superior, cuerpo trapezoides y lemnisco lateral, convergen en el colículo inferior para luego continuar hacia el cuerpo geniculado medial y alcanzar finalmente la corteza auditiva, en el lóbulo temporal, donde se hace consciente la percepción del sonido.
Fibras de la vía auditiva eferente llegan al órgano de Corti haciendo un control central de las señales aferentes al sistema nervioso (Saldaña y Merchán, 1998; Suárez y cols., 2007).
Vía auditiva aferente
El conjunto de fibras aferentes y eferentes que entran en el órgano de Corti discurren por el interior de la lámina espiral ósea atravesándola por la habénula perforata hasta alcanzar el túnel de Corti, donde se disponen en haces radiales y espirales para distribuirse a lo largo de toda la cóclea y contactar con las células ciliadas.
Según las características morfológicas de las neuronas bipolares del ganglio espiral, se clasifican en tipo I y II. Las de tipo I son el 90% del total, de cuerpo celular grande y gruesas prolongaciones, ambos cubiertos de vaina de mielina, lo que favorece una rápida conducción de la señal nerviosa. Las de tipo II son el 10% del total, con cuerpo pequeño, delgadas prolongaciones y sin vaina de mielina, lo que condiciona una lenta transmisión nerviosa. Las dendritas o aferentes del tipo I hacen sinapsis en una proporción de 10 fibras nerviosas por cada célula ciliada interna.
Las menos numerosas fibras de tipo II, se han de distribuir entre las tres veces más numerosas células ciliadas externas, por lo que la proporción es de una fibra de tipo II por cada diez células ciliadas externas. Teniendo en cuenta la relación entre el número de fibras aferentes y eferentes, en las ciliadas internas predominan las primeras frente a las eferentes, que contactan principalmente sobre el axón aferente y rara vez sobre la base de la célula.
Los axones de las neuronas ganglionares se reúnen en el eje central del modiolo para salir por la criba espiroidea constituyendo el nervio coclear, que junto al nervio vestibular forma el nervio cócleo vestibular o estatoacústico (VIII par craneal). Este atraviesa el conducto auditivo interno para entrar en la cavidad craneal y alcanzar la región del bulbo raquídeo del troncoencéfalo. Aquí se establecen contactos sinápticos con las segundas neuronas de la vía auditiva aferente localizadas en los núcleos cocleares (Figuras 1, 2, 4 y 8) (Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
Cuando los axones del nervio coclear entran en los núcleos cocleares se bifurcan alcanzando sus ramas anteriores, la división anteroventral, y las posteriores, las divisiones posteroventral y dorsal.
El núcleo coclear ventral está dividido a su vez en núcleo coclear ánteroventral (donde predominan las células esféricas, globulares, multipolares y grano) y núcleo coclear posteroventral (donde predominan las células pulpo, multipolares y grano).
En el núcleo coclear dorsal se encuentran las células gigantes, fusiformes o piramidales y grano. En la raíz del nervio coclear de roedores se ha descrito una población de neuronas de la raíz que proyectan al núcleo reticular pontino e intervienen en el reflejo auditivo del sobresalto o de alerta. La mayoría de las neuronas de los núcleos cocleares anteroventral y posteroventral envían sus axones al complejo olivar superior, predominando la proyección contralateral sobre la ipsilateral. Los axones procedentes del núcleo anteroventral hacen relevo en el núcleo olivar superior lateral ipsilateral y en el medial bilateral (Angulo, 1987; Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007). Los que cruzan la línea media, vía cuerpo trapezoides, también hacen sinapsis en el núcleo de dicho cuerpo.
En la raíz del nervio coclear de roedores se ha descrito una población de neuronas de la raíz que proyectan al núcleo reticular pontino e intervienen en el reflejo auditivo del sobresalto o de alerta.
Los axones del núcleo posteroventral proyectan al colículo inferior contralateral, enviando una rama al núcleo olivar superior lateral homolateral y al núcleo ventral del lemnisco lateral contralateral. El conjunto de estos axones que cruzan la línea media bulbar, junto con los procedentes del núcleo coclear dorsal en dirección al colículo inferior, constituyen las estrías acústicas.
Los axones de neuronas olivares que se dirigen hacia el colículo inferior, junto con los procedentes de los núcleos cocleares, forman parte del lemnisco lateral. Algunos de ellos contactan con células del núcleo ventral en él intercalado. Los axones de neuronas lemniscales cruzan hacia los núcleos del lemnisco lateral contralateral a través de la comisura de Probst (Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
El conjunto de los axones que cruzan la línea media bulbar, junto con los procedentes del núcleo coclear dorsal en dirección al colículo inferior, constituyen las estrías acústicas.
El colículo inferior es uno de los niveles más importantes y de mayor tamaño de la vía auditiva, que recibe aferencias bilaterales del complejo olivar superior y contralaterales de los núcleos cocleares, principalmente del dorsal. Las proyecciones que alcanzan esta región del mesencéfalo sinaptan tonotópicamente sobre neuronas de áreas específicas. En él se distingue una corteza dorsal y ventral que rodea a un núcleo central organizado en planos de isofrecuencia.
A través de la comisura del colículo inferior interconectan neuronas de ambos colículos y cruzan fibras hacia el cuerpo geniculado.
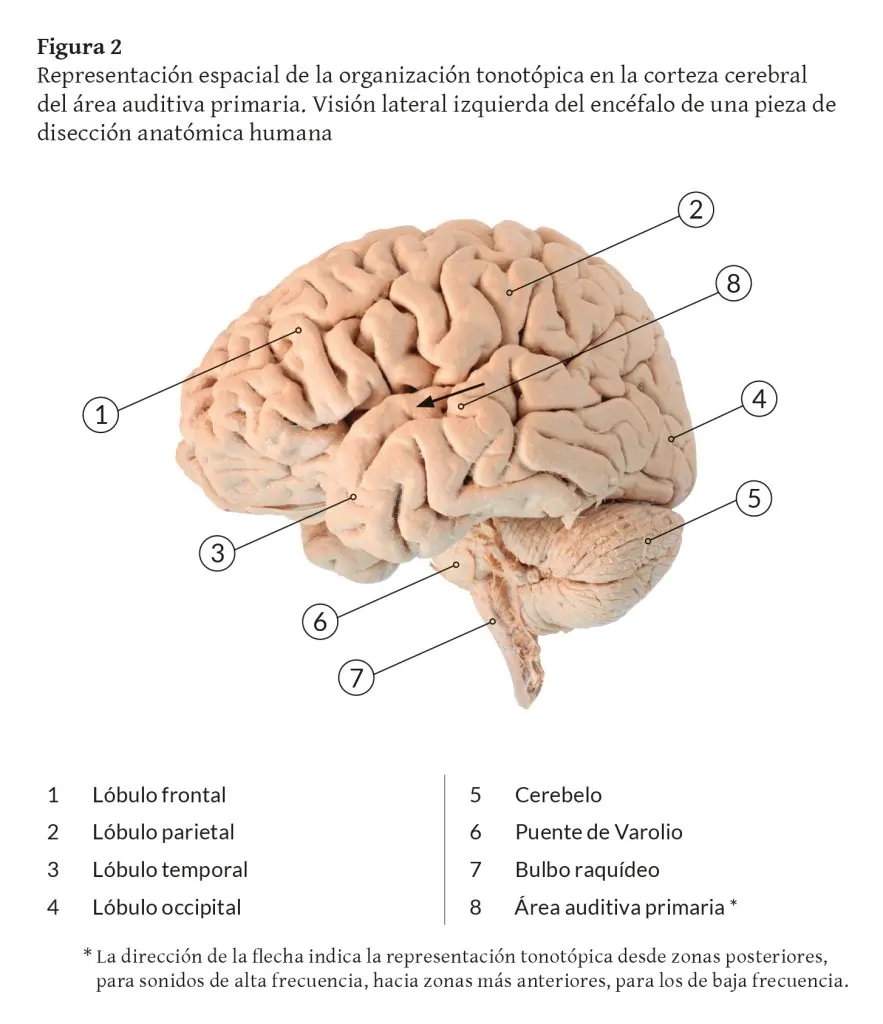
Las áreas auditivas I (primaria) y II (secundaria) corresponden a las clásicas áreas 41 y 42 de Brodman, situadas en las inmediaciones de la cisura de Silvio del lóbulo temporal. La corteza auditiva primaria, que recibe aferencias de la división ventral del cuerpo geniculado medial talámico, se encuentra rodeada por la corteza auditiva secundaria, donde proyectan tonotópicamente las otras divisiones del cuerpo geniculado.
El área auditiva primaria la constituye la porción media de la circunvolución temporal superior y está en relación con los tonos y otras cualidades de los sonidos (Figura 12). El área auditiva secundaria (resto del área auditiva) está en relación con el significado de las palabras y el reconocimiento de la música.
A estas áreas hay que añadirles la de integración sensitiva (área de Wernicke) que relaciona la información sensorial somática, visual y auditiva; y corresponde a la parte posterior de la zona superior temporal en contacto con los lóbulos parietal y occipital (Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
El área auditiva primaria está en relación con las cualidades de los sonidos, mientras que el área auditiva secundaria se asocia con el significado de las palabras y el reconocimiento de la música.
Vía auditiva eferente
Por medio de la vía auditiva eferente o descendente se controla o regula la respuesta al sonido del receptor coclear mediante mecanismos inhibitorios. Discurre paralela a la vía aferente. Las principales proyecciones descendentes de la corteza auditiva son hacia el cuerpo geniculado medial y colículo inferior. A partir de este hay proyecciones directas y cruzadas al complejo olivar superior, del que parten las fibras del haz olivococlear de Rasmussen (Ryugo, 2011; Saldaña y cols., 1996).
Los axones de neuronas del núcleo olivar superior medial terminan, fundamentalmente, sobre las células ciliadas externas de la cóclea contralateral, mientras que proyecciones del núcleo olivar superior medial acaban con mayor predominio sobre los aferentes que sinaptan con las células ciliadas internas ipsilaterales. Los núcleos cocleares reciben eferencias del complejo olivar superior, de los núcleos del lemnisco lateral y del colículo inferior, pero no proyectan eferencias a la cóclea (Bartolomé y Gil-Loyzaga, 2005; Suárez y cols., 2007).
Funciones de las vías auditivas
La principal función de la vía auditiva aferente, en coordinación con la eferente, es la integración del mensaje sonoro para, en última instancia, conseguir la percepción consciente del sonido o sensación sonora. La integración del mensaje sonoro se realiza cuando la información sobre intensidad, frecuencia y duración del estímulo sonoro (transformado ya en impulso nervioso por las células sensoriales) es codificada por tipos neuronales especializados en cada nivel de la vía auditiva que, a través de complicadas relaciones sinápticas, responden o no de forma específica. Mediante registros electrofisiológicos se ha determinado la organización tonotópica (mapas de frecuencias) en cada región de la vía auditiva, que se corresponden con la que existe en la cóclea y en el nervio coclear (Haines, 2013; Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
Cuando este mensaje codificado alcanza la corteza auditiva se consigue la percepción consciente del sonido, ya que, tras conexiones con otras regiones corticales dedicadas a diversas funciones (motoras, sensitivas y vegetativas) y con otros niveles del sistema nervioso central (implicados de forma aún no bien determinada en la conciencia y en el psiquismo humano), la sensación sonora adquiere una determinada simbolización o significado para el oyente.
CODIFICACIÓN DEL SONIDO EN LAS FIBRAS DEL NERVIO ACÚSTICO
A través de las fibras o axones del nervio coclear o acústico se transmite la información sobre el estímulo sonoro, desde el órgano de Corti a los centros auditivos superiores. La duración del estímulo sonoro queda codificada en función directa a la duración de la activación. La intensidad del sonido está determina da directamente por el número de fibras aferentes activadas del nervio coclear. Sonidos intensos provocan un fuerte estímulo en el órgano de Corti, excitando a numerosas células sensoriales que a su vez activan a gran número de fibras con distintos umbrales de excitabilidad (unas responden a débiles excitaciones y otras a fuertes).
La frecuencia del sonido está relacionada con el número de impulsos nerviosos transmitidos en la fibra nerviosa por unidad de tiempo. Si la frecuencia de vibración de una zona de la membrana basilar es alta, las células se excitarán un alto número de veces por unidad de tiempo, desencadenando, en la misma medida, la activación de las fibras cocleares correspondientes tonotópicamente (frecuencia característica de la fibra nerviosa) (Haines, 2013; Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
AUDICIÓN BIAURAL Y LOCALIZACIÓN DEL SONIDO
La audición biaural permite localizar espacialmente la fuente sonora según la dirección de procedencia de un sonido respecto a ambos oídos. En este proceso intervienen dos hechos físicos. Uno es la diferencia en el tiempo de llegada del frente de ondas de presión sonora a cada oído (en el humano normal es de apenas 50 µseg). El otro es la diferencia en la intensidad del sonido que llega a cada oído (de 1 dB como mínimo en el humano normal).
El mensaje sonoro recogido por ambos oídos es comparado y elaborado a nivel del colículo inferior. Este reúne y combina las informaciones codificadas en los núcleos del complejo olivar superior para ser analizadas por el núcleo coclear dorsal. Las neuronas de los núcleos olivares superiores lateral y medial, relacionados con las frecuencias altas y bajas respectivamente, responden ante diferencias de intensidad y duración del sonido, contribuyendo con estos parámetros en la codificación de la dirección de un sonido en el espacio. Con audición monoaural (con un oído), muy frecuente en los hipoacúsicos, falta la información comparativa entre ambos oídos a nivel del sistema nervioso, quedando mermada la capacidad de localización sonora.
Por otro lado, gracias a la audición biaural se consigue una filtración selectiva del sonido que mejora la audibilidad de una señal en unos 10 dB. En un entorno con ruidos o varios interlocutores, las diferencias interaurales en el tiempo e intensidad del sonido se utilizan por el sistema nervioso central para reprimir el ruido de fondo (generalmente graves) y resaltar la señal interesante, mejorando así su audición (Haines, 2013; Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
ADAPTACIÓN AUDITIVA
En los mecanismos de adaptación o acomodación al estímulo sonoro están im plicadas neuronas del núcleo coclear ventral, núcleo olivar superior medial, colículo inferior y núcleos motores de los nervios facial y trigémino. Ante sonidos de moderada intensidad se contraen de forma refleja los músculos del martillo y estribo del oído medio, dificultando la transmisión por inmovilización de la membrana timpánica y cadena osicular. Al tiempo que de esta forma se aumenta el umbral de audición para adaptarse a estos sonidos, se produce una disminución de la capacidad discriminatoria tonal (Haines, 2013; Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).
La velocidad de transmisión de ondas viajeras a través de la membrana basilar es más lenta que por el líquido, tardando entre 2 y 5 milisegundos en recorrer los 35 mm de la cóclea.
ENMASCARAMIENTO AUDITIVO
Un sonido puede enmascarar a otro, impidiendo que sea percibido, cuando un tono o sonido es más intenso que el otro (el débil queda enmascarado). Si ambos sonidos proceden de una misma dirección es más probable el enmascaramiento de uno de ellos, que si proceden de direcciones distintas. Dos sonidos de frecuencias similares son difíciles de discriminar al enmascararse el más agudo por el más grave (Haines, 2013; Purves, 2015; Saldaña y Merchán, 1998; Suárez y cols., 2007).